El jabón es un ácido o una base y cómo funciona?
Qué es el jabón?
En química, jabón es un sal de un ácido graso . Los jabones se utilizan principalmente para lavado , baños , y limpieza . Los jabones para limpieza se obtienen tratando aceites y grasas vegetales o animales con un fuerte alcalino solución. Las grasas y los aceites se componen de triglicéridos ; tres moleculas de ácidos grasos están unidos a una sola molécula de glicerol . La solución alcalina, que a menudo se llama lejía (aunque el término "jabón de lejía" se refiere casi exclusivamente a jabones elaborados con hidróxido de sodio ), provoca una reacción química conocido como saponificación . En esta reacción, las grasas de triglicéridos se hidrolizan primero en ácidos grasos libres y luego se combinan con el álcali para formar jabón crudo, una amalgama de varias sales de jabón, exceso de grasa o álcali, agua y se libera. glicerol (glicerina). La glicerina es un subproducto útil que puede dejarse en el producto de jabón como agente suavizante o aislarse para otros usos.
Cómo funciona el jabón?
El jabón es un excelente limpiador debido a su capacidad para actuar como agente emulsionante. Un emulsionante es capaz de dispersar un líquido en otro líquido inmiscible. Esto significa que, si bien el aceite (que atrae la suciedad) no se mezcla naturalmente con el agua, el jabón puede suspender el aceite o la suciedad de tal manera que se pueda eliminar.
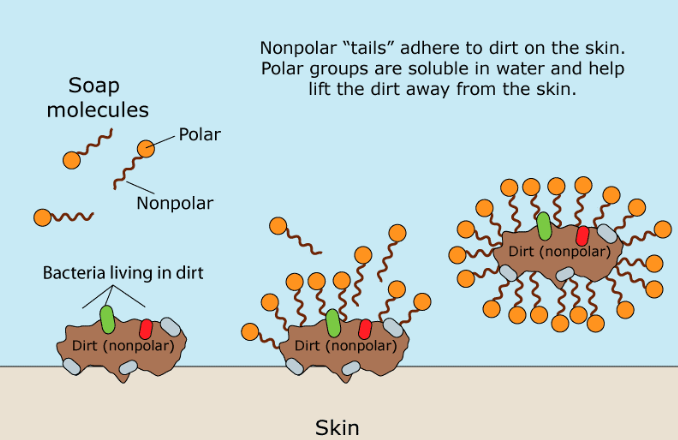
La parte orgánica del Jabón Natural es una molécula polar cargada negativamente. Su grupo carboxilato hidrófilo (-CO2) interactúa con las moléculas de agua a través de interacciones ion-dipolo y enlaces de hidrógeno. La parte hidrofóbica (que teme al agua) de una molécula de jabón, su larga cadena de hidrocarburos no polares, no interactúa con las moléculas de agua. Las cadenas de hidrocarburos se atraen entre sí mediante fuerzas de dispersión y se agrupan formando estructuras llamadas micelas. En estas micelas, los grupos carboxilato forman una superficie esférica cargada negativamente, con las cadenas de hidrocarburos dentro de la esfera. Debido a que están cargadas negativamente, las micelas de jabón se repelen y permanecen dispersas en el agua.
La grasa y el aceite son apolares e insolubles en agua. Cuando se mezclan jabón y aceites contaminantes, la porción de hidrocarburo no polar de las micelas rompe las moléculas de aceite no polar. Luego se forma un tipo diferente de micela, con moléculas de suciedad no polares en el centro. De este modo, la grasa, el aceite y la "suciedad" adherida a ellos quedan atrapados dentro de la micela y se pueden enjuagar.
El jabón es un ácido o una base?
El jabón no es completamente un ácido o una base, es una sal básica. Es una combinación de ácido débil y base fuerte. Cuando un ácido y una base se combinan en una cierta cantidad, forman sal y agua. Y cuando la sal tiene una base más fuerte en su combinación, muestra naturaleza básica.
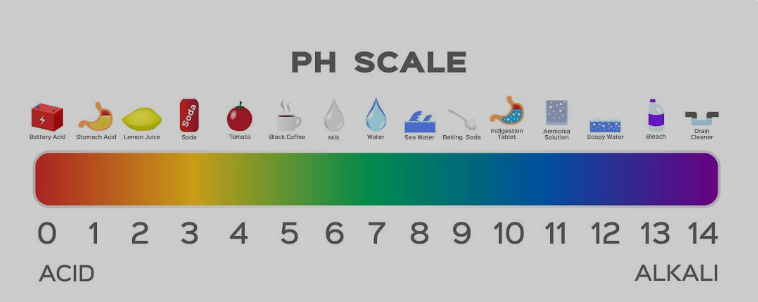
Es el jabón un ácido/base fuerte o débil?
El jabón tiene una naturaleza básica débil. Aunque se utilizan bases fuertes para fabricar jabones, los ácidos débiles utilizados en la reacción neutralizan los efectos hasta cierto punto. Cuando usas una tira de pH para medir, la mayoría de los jabones muestran un pH de 9 a 10. Mientras que las bases fuertes están entre 12 y 14 en la escala de pH.